Vědci odhalili skrytou funkci buněčného komplexu: ukázali, jak transportuje lipidy
Nový výzkum odhalil, že proteinový kanál Sec61/TRAP, známý především jako vstupní brána pro bílkoviny do endoplazmatického retikula – buněčné továrny na výrobu proteinů – hraje klíčovou roli i v transportu lipidů napříč buněčnou membránou. Tento překvapivý objev ukazuje, jak flexibilně buňky využívají své molekulární nástroje pro zajištění stability a funkčnosti.
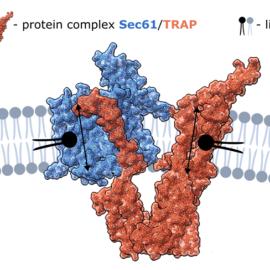
Tým vědců z Ústavu fyzikální chemie J. Heyrovského, Masarykovy univerzity a univerzit ve finském Tampere a Helsinkách odhalil novou funkci jednoho z nejdůležitějších proteinových kanálů v lidském těle – Sec61/TRAP komplexu– doposud známého především tím, že umožňuje nově vzniklým proteinům vstoupit do tzv. endoplazmatického retikula (ER), vnitrobuněčné továrny, kde buňka vyrábí a upravuje bílkoviny a tuky potřebné pro svůj růst a správné fungování. Jak ukazuje článek, nedávno publikovaný v prestižním časopise Journal of the American Chemical Society, Sec61/TRAP komplex má ještě jednu překvapivou funkci: pomáhá přesouvat lipidy (tuky) napříč buněčnými membránami.
Buněčné membrány nejsou jen pasivní obaly, ale dynamické struktury tvořené vrstvami lipidů, které určují, co se dostane dovnitř a co zůstane venku. Aby správně fungovaly, musí mít vyvážené složení na obou stranách. Tato rovnováha však není samozřejmá – zatímco většina lipidů vzniká na jedné straně membrány, buňka je musí efektivně přemístit i na druhou stranu. A právě zde hrají roli specializované proteiny, které umožňují tento přenos bez spotřeby energie.
Sec61/TRAP byl už v minulosti popsán jako molekulový komplex, který přes membránu endoplazmatického retikula transportuje proteiny, určené k dalším úpravám. Nová studie však ukázala, že kromě proteinů může Sec61/TRAP transportovat i lipidy. Zásadním zjištěním je, že i když je hlavní kanál Sec61 zablokován, přemísťování lipidů stále probíhá. To naznačuje existenci alternativní cesty. Tu zajišťuje protein TRAP tvořící tzv. polární štěrbinu – úzký průchod, kterým může lipid projít způsobem připomínajícím mechanismus použití kreditní karty. Lipidová hlavička klouže štěrbinou, zatímco její hydrofobní část zůstává v prostředí membrány, čímž se minimalizuje energetická náročnost.
„Výzkum funkce Sec61/TRAP staví na dřívější práci finských vědců, kteří pomocí elektronové mikroskopie určili strukturu komplexu. Na jejím základě jsme potom mohli předpovědět novou funkci Sec61/TRAP s pomocí počítačových simulací. U nás na ústavu J. Heyrovského jsme využili metody fluorescenční spektroskopie, abychom aktivitu Sec61/TRAP prokázali experimentálně.“ říká Radek Šachl z Ústavu fyzikální chemie J. Heyrovského.
Kombinace výpočetních a experimentálních metod tak pomohla pochopit molekulární mechanismus, jakým Sec61/TRAP transportuje lipidy. Díky svým specifickým strukturním vlastnostem totiž proteinový komplex přenáší lipidy spontánně, bez spotřeby energie.
"Bylo to jako objevit tajné dveře, které celou dobu existovaly vedle těch hlavních," komentují objev hlavní autoři článku. Objev přináší nové porozumění tomu, jak si buňky udržují membránovou rovnováhu. „Nejprve se zdálo, že lipidový transport zprostředkovává kanál tvořený proteinem Sec61. Po jeho zablokování inhibitory, které se do proteinu chemicky navážou, a tím jej zablokují, jsme však mohli transport lipidů pozorovat i nadále, v nezměněné míře. V souladu s počítačovými simulacemi jsme tak objevili nový polární kanál, umožňující transport lipidů, tvořený TRAP doménou.“ říká Jan Šimek z Ústavu fyzikální chemie.
Vědecká komunita již dříve diskutovala možnost utlumení růstu nádorových buněk nebo zastavení šíření virové infekce právě blokací Sec61. Přesnější pohled na jeho funkci tak dává důležitý kontext nejen studiu fyziologie buněčných membrán, ale i vývoji nových léčiv.
Radek Šachl
Doc. Dr. Radek Šachl vystudoval fyzikální chemii na Přírodovědecké fakultě UK. PhD obdržel na Umeå Universitet ve Švédsku a zároveň na Přírodovědecké fakultě UK. Působil na Královském technologickém institutu ve Stockholmu. Roku 2018 získal pozici pro mladé začínající vědce na Ústavu fyzikální chemie Jaroslava Heyrovského. V současnosti se věnuje výzkumu protein-membránových interakcí na oddělení Biofyzikální chemie na Ústavu fyzikální chemie J. Heyrovského AV ČR.
Mgr. Jan Šimek vystudoval biochemii na Přírodovědecké fakultě Masarykovy univerzity. V současnosti se věnuje doktorskému studiu fyzikální chemie na Přírodovědecké fakultě Univerzity Karlovy, zatímco výzkumnou činnost provádí na Ústavu fyzikální chemie J. Heyrovského.
Dr. Denys Biriukov studoval biofyziku na Charkivské národní univerzitě na Ukrajině. Získal titul Ph.D. v oboru biofyziky na Jihočeské univerzitě v Českých Budějovicích v roce 2020. Působil jako postdoktorand na Ústavu organické chemie a biochemie v Praze a na CEITEC Masarykovy univerzity v Brně. V současnosti působí jako výzkumný pracovník a řešitel projektu na Přírodovědecké fakultě Masarykovy univerzity. Ve svém výzkumu se zaměřuje na molekulární simulace membrán, proteinů a sacharidů.
Ústav fyzikální chemie J. Heyrovského AV ČR je veřejná výzkumná instituce, jež rozvíjí badatelskou činnost ve fyzikální chemii a chemické fyzice se zaměřením na vztahy mezi strukturou a reaktivitou látek. Soustřeďuje se zejména na teoretický a experimentální výzkum chemických a fyzikálně-chemických dějů na atomární a molekulární úrovni (struktura a dynamika látek, mechanismus reakcí) v plynné, kapalné a pevné fázi a na jejich rozhraních, a to především v systémech významných pro chemickou katalýzu a sorpční, elektrochemické a biologické procesy (včetně přípravy a charakterizace nových katalytických, sorpčních, elektrodových a jiných speciálních materiálů).